积跬步,方能至千里——中国上市药品相关专利信息登记平台已公示专利声明之初体验
作者 | 寇飞 北京市永新智财律师事务所
编辑 | 季文梨
中国上市药品相关专利信息登记平台(以下简称“登记平台”)是药品专利纠纷早期解决机制的基础数据库,是药品上市许可申请人与药品上市许可持有人、有关专利权人或者利害关系人的信息沟通交流平台。
登记平台于2021年5月18日至6月29日起公开测试,自7月4日起正式运行,6月28日公示了首批专利信息,7月9日公示了首条专利声明信息,每一个举措,每一条信息,都是职能部门和市场主体像婴儿学步一般地对药品专利链接这个崭新制度的大胆探索和有力尝试。
截至目前,登记平台已累积了一定量的数据,我们以2021年8月20日收录的数据为样本进行客观分析,所有相关的法律事件和状态也以该时间节点为准。我们试图找出点瑕疵,提出些问题,未必都有答案,但至少多些思路,最好再能给出点建议。
一、数据基本统计
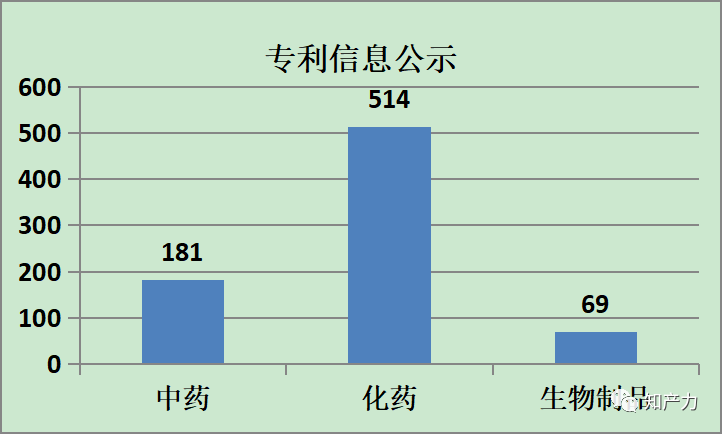
(一)专利信息公示
专利信息公示的数据如下,具体分析将在另文展开,本文专注于专利声明。
(二)专利声明
登记平台共有专利声明信息192条,排除明显属于重复提交的4条信息,在列专利声明信息共188条。专利声明的序号大致按受理日期和在登记平台上的公示日期早晚升序排列,但持续观察发现,部分序号会有变动。
1、药品类型
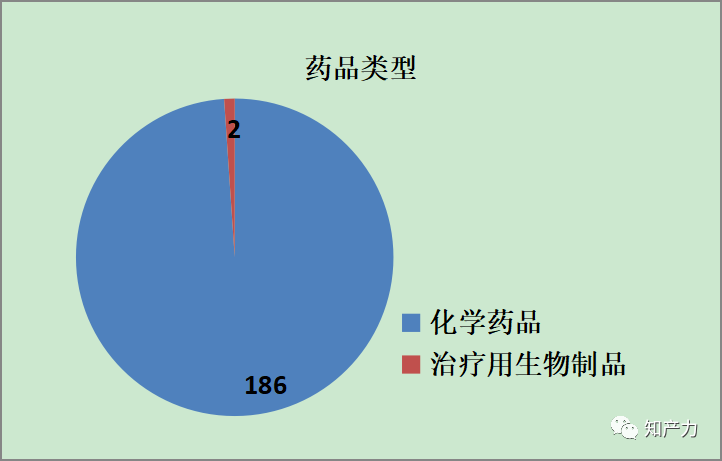
化学药品占绝大多数,暂时没有中药。两个治疗用生物制品分别为贝伐珠单抗注射液和注射用曲妥珠单抗,注册分类为3.3类,即生物类似药,这是《药品专利纠纷早期解决机制实施办法(试行)》(以下简称“实施办法”)中明确要求进行专利声明的生物制品,专利声明为1类。
与化学仿制药不太一样,生物类似药研发成本高,研究和评价要求高。以上述两款生物制品为例,更多企业选择以2.2类(增加境内外均未获批的新适应症和/或改变用药人群)改良型生物制品申报,这可能是生物制品专利声明较少的原因之一。
2、注册分类(化学药品)
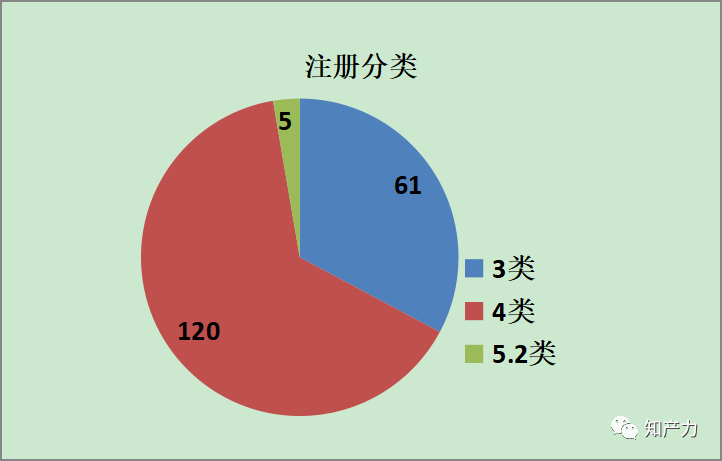
186个化学药品中,4类仿制药占比65%,3类仿制药占比33%,另有2%的5.2类仿制药。
3、专利声明类型
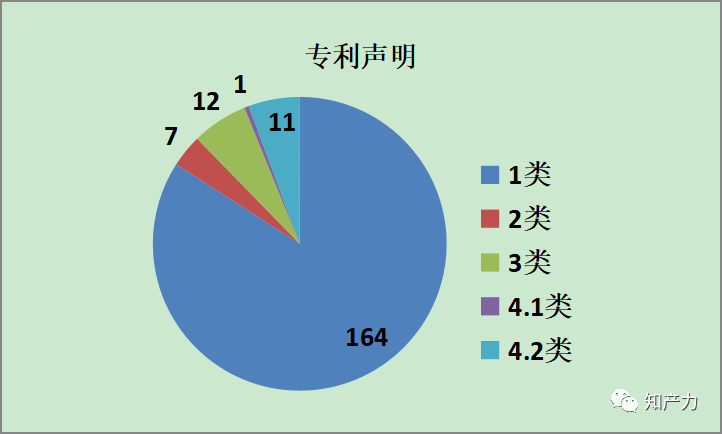
在188条专利声明信息中,共190份专利声明。个别药品涉及多个品规,或者多个专利。对于不同品规的相同类型的专利声明,或者相同药品或品规下的多个不同类型的专利声明分别计数;但对于相同药品或品规下的多个专利对应的相同专利声明不重复计数。详细分析见第二部分。
4、药品上市许可持有人(MAH)
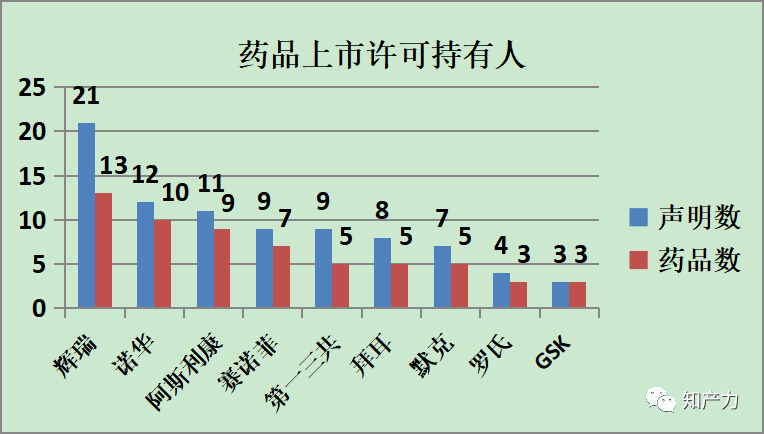
为了便于统计,将含有共同的制药集团公司商号的若干个MAH作为关联公司归属于该制药集团公司。拥有声明数量排名靠前的几家公司如上图。由于同一药品可能涉及不同专利和品规,因此声明数往往大于药品数。
5、药品名称
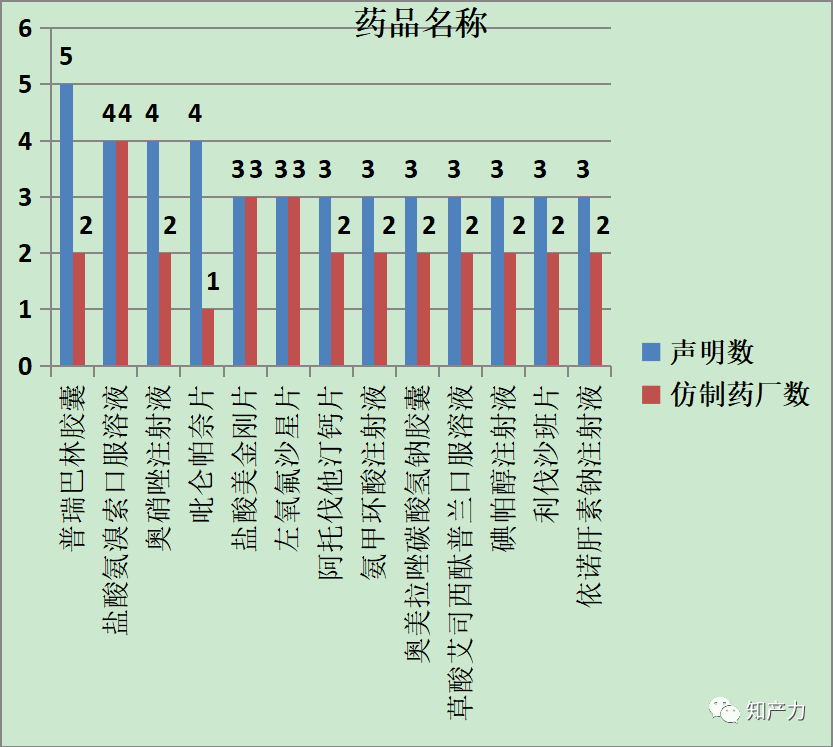
声明数排名靠前的药品如上所示,由于同一药品可能涉及不同专利和品规,同一仿制药申请人可能针对同一药品的不同品规分别做出专利声明,因此声明数往往大于仿制药厂数。基于仿制药厂数可以初步推断较热门的被仿制药,例如盐酸氨溴索口服溶液、盐酸美金刚片和左氧氟沙星片等。
6、仿制药申请人
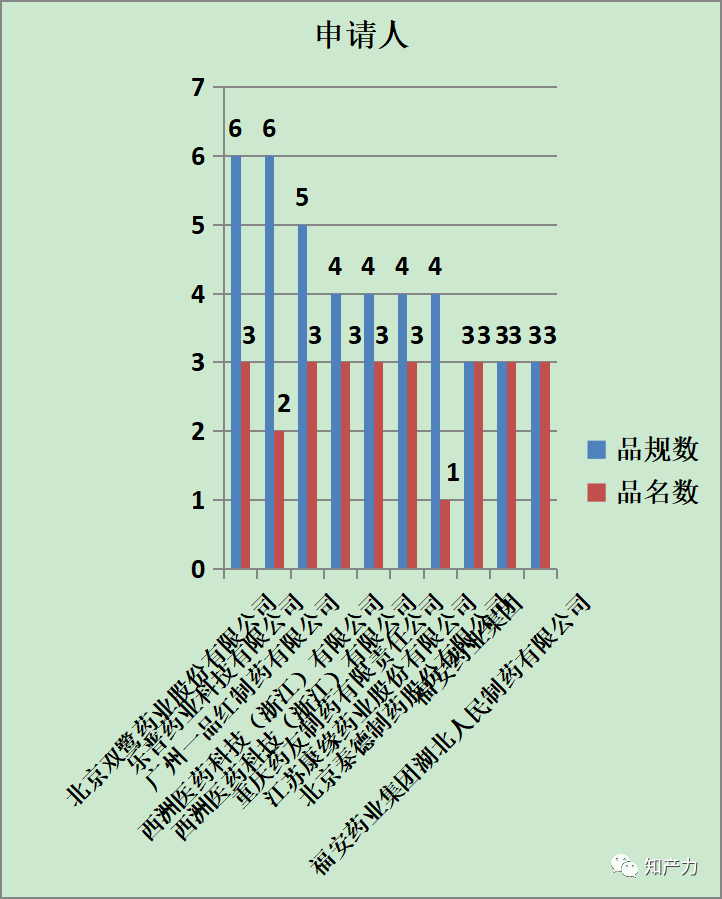
较为活跃的仿制药申请人如上所示,由于同一药品可能涉及不同品规,同一仿制药申请人可能针对同一药品的不同品规分别做出专利声明,因此品规数往往大于品名数。
二、专利声明具体分析
(一)1类声明:早作踏实,夜长梦多
1类声明占比86%。对于仿制药申请人而言,这是最容易作出的声明,也越早作出越好。如果MAH在登记平台上的专利登记公开时间晚于仿制药申请人的1类声明受理日期,便可能丧失启动药品专利纠纷早期解决机制的权利。
(二)2类声明:“宣告无效”认定存疑
2类声明涉及3种化学药品共7个品规。以恩格列净片为例,该2类声明针对3项专利,并列明了登记的权利要求项编号,但在备注栏中并未按照要求注明相应的具体情形(专利权终止或无效,获得许可)。
1、“宣告无效”是否需要无效决定生效?
经核实,201310368328.4和201310379906.4的相关权利要求1在2020年底均被无效,推测目前应处于行政诉讼阶段,无效决定应该尚未生效。相应地,MAH于2021年6月底在平台上登记时,这两项权利要求的状态标记为“有效”。对于这两个专利,究竟是2类声明还是4.1类声明,这是一个问题。
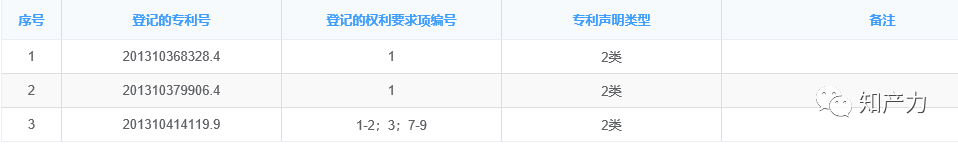
2、对专利声明能否异议?
201310414119.9登记的权利要求为1-2,3,7-9,2020年8月,权利要求1-6被宣告无效,在权利要求7-9的基础上维持该专利有效。针对权利要求7-9的2类声明如果意指其被宣告无效,就不妥了。
实施办法第四条第2款针对MAH登记信息有异议途径;对于不实声明,虽然在第十五条中规定了罚则,但MAH是否可以提出异议,如何提出异议,在实施办法中没有明确规定。
(三)3类声明:艰难的抉择与隐忍
1、我能想到的最理智的事,就是等你慢慢变老
3类声明共涉及10种化学药品共12个品规。在这10种药品中,登记专利数多于1个的共有5种。已有的公开数据显示,3类声明涉及的绝大多数专利并未经历无效宣告程序,这一方面体现出仿制药申请人的审慎,另一方面也反映出这些专利相对较高的稳定性。
除了甲磺酸仑伐替尼胶囊的1个专利权有效期即将届满之外,3类声明涉及的其他专利权有效期普遍较长。这也意味着,仿制药注册申请技术审评通过的,虽然国家药品监督管理局(以下简称“药监局”)会作出批准上市决定,但相关药品在相应专利权有效期届满之后方可上市。
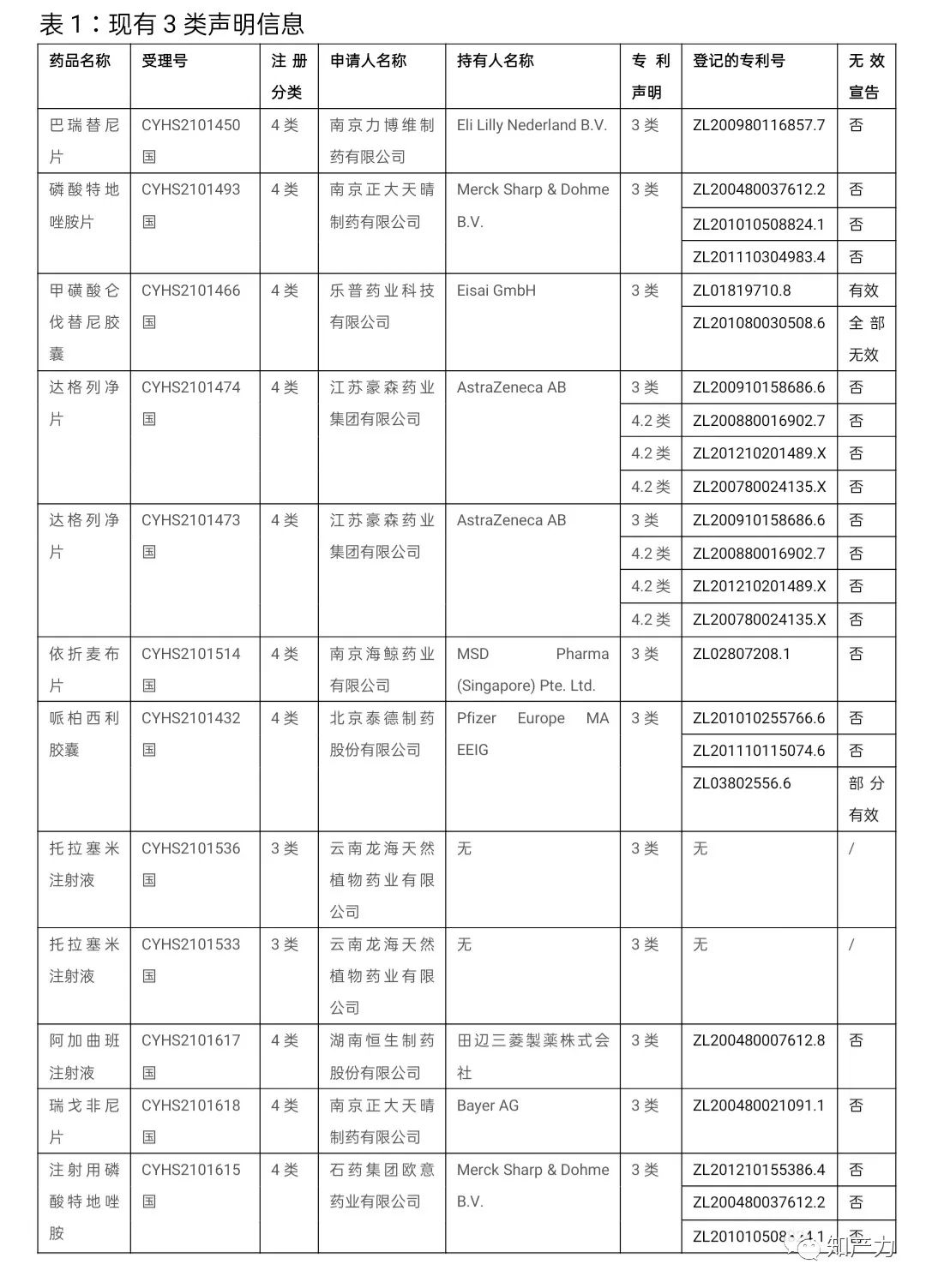
2、被宣告无效的专利还需要等待期满吗?专利权有效期何时届满?
仍以甲磺酸仑伐替尼胶囊为例,ZL01819710.8专利经历无效宣告程序并维持有效,专利权有效期至2021年10月19日。ZL201080030508.6于2021年4月29日被国家知识产权局宣告无效,无效请求人是南京正大天晴制药有限公司。2021年7-8月间,包括南京正大天晴制药有限公司在内的4家公司的4类仿制药陆续获批上市。
实施办法生效后,乐普药业科技有限公司(以下简称“乐普公司”)的专利声明于2021年7月21日获得受理,其4类仿制药上市申请(ANDA)于7月24日获得承办。按照ANDA目前平均约1.5-2年的技术审评周期,一旦技术审评通过,很有可能出现的情况是ZL01819710.8专利权有效期已届满,ZL201080030508.6仍在专利无效行政诉讼程序中。药监局如果做出批准上市决定,乐普公司的甲磺酸仑伐替尼胶囊仿制药能否即时上市,还是需要等待无效程序的最终结果?这又涉及对被无效专利的有效性认定问题。当然,乐普公司既已作出专利声明并且ANDA申请已被受理,不必因专利权状态调整专利声明。
对于2021年10月19日之后提出ANDA申请的仿制药申请人,针对ZL01819710.8显然会作出2类声明,但对于已被宣告无效、无效决定尚未生效、专利权尚未届满的ZL201080030508.6,究竟是作出3类声明,还是2类声明(相关专利权被宣告无效)或4.1类声明?
3、专利权有效期届满后MAH如何在登记平台更新信息
作为MAH的Eisai GmbH,在ZL01819710.8专利权有效期届满后,按照实施办法第四条的规定,应当在该信息变更生效后30日内完成更新。但已被宣告无效、无效决定尚未生效的ZL201080030508.6,专利状态是否发生变化,该信息变更何时生效?这也是个问题。
4、避免乌龙,减少麻烦
托拉塞米注射液相关的两个3类声明缺少持有人名称和登记的专利号,且专利信息登记平台上并无该药品的登记专利,该药品已获批上市的两家药企和目前的申请人的注册分类均是3类。这两个3类声明看来是个乌龙。
(四)4类声明:刚柔并济有技巧
1、除了硬碰硬,还能绕道行
4类声明涉及6种化学药品共7个品规,其中包括针对1种药品的4.1类声明(相关专利权应当被宣告无效)和针对5种药品的4.2类声明(仿制药未落入相关专利权保护范围)。仿制药申请人更多选择了绕道走。
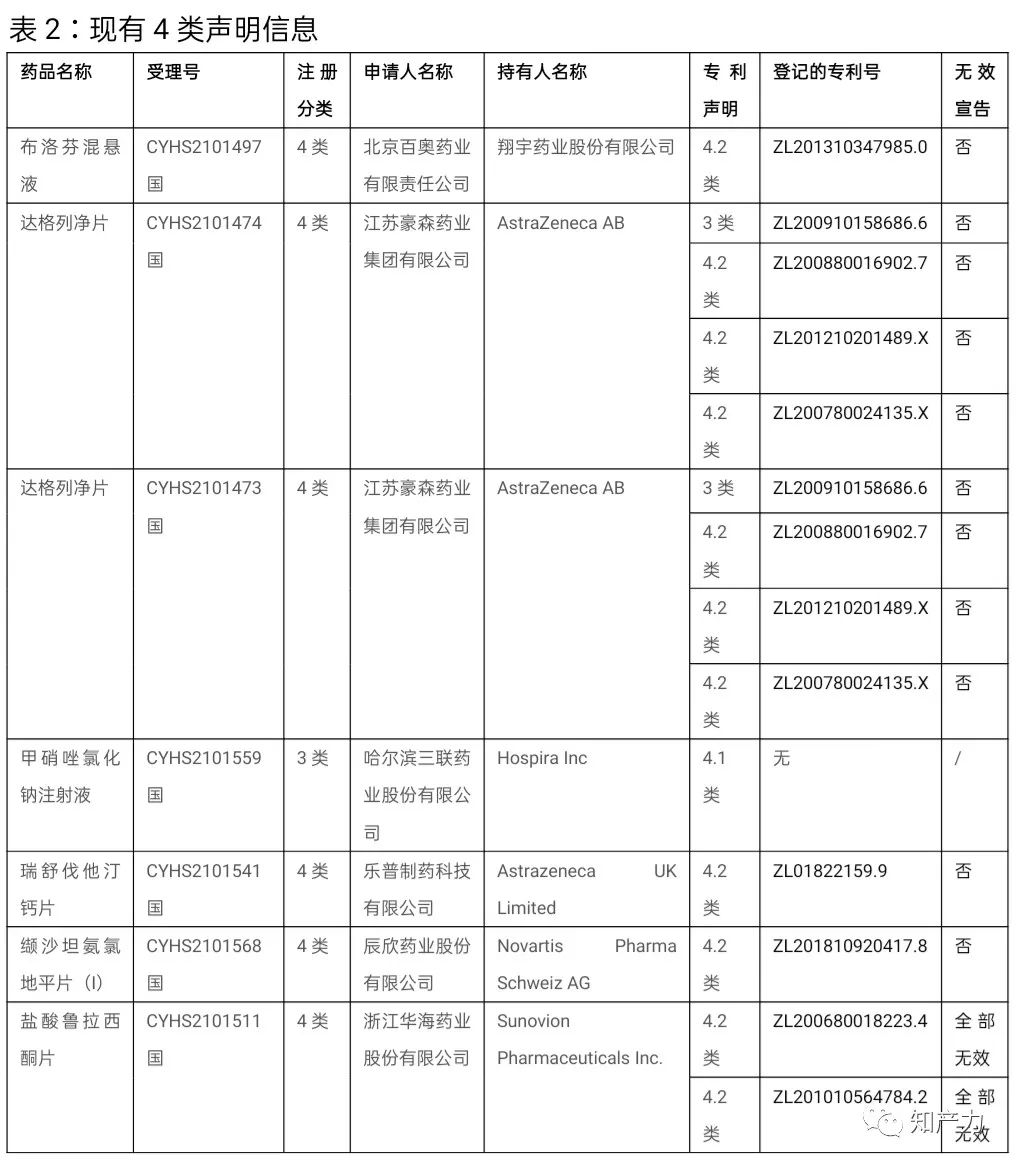
2、专利挑战没你想得那么频发
已有的公开数据显示,大多数专利目前并未经历无效宣告程序。这一方面反映出这些专利相对较高的稳定性,另一方面也体现出仿制药申请人的审慎,这从占大多数的是4.2类声明而非4.1类声明也可得到佐证。这其中,除了瑞舒伐他汀钙片的1个专利权有效期即将届满之外,其他专利权有效期普遍较长。
市场独占期固然充满诱惑,首个挑战成功并首个获批上市的“双首个”要求不可谓不严格,《专利审查指南》征求意见稿对于“首个挑战成功”的限定不可谓不严格,但显然专利挑战需要更周密的准备。当然,更多的专利挑战也有可能在运筹之中。
事实上,唯一一个4.1类声明,由于缺少登记的专利号,且专利信息登记平台上并无该药品的登记专利,并且该药品目前已有128家企业获批上市,这个4.1类声明看来又是一个乌龙。
3、“被仿制药”的“相关的药品专利”含义不明确
缬沙坦氨氯地平片(I)是一个混搭,被仿制药来自早年上市的Novartis Pharma Schweiz AG(以下简称“Novartis公司”),但其并未在专利信息登记平台上就该药品登记专利。辰欣药业股份有限公司(以下简称“辰欣公司”)作出的4.2类声明中涉及的专利ZL201810920417.8实际专利权人是北京百奥药业有限责任公司(以下简称“百奥公司”),其缬沙坦氨氯地平片(I)的4类仿制药于2020年初获批上市,并在2021年7月22日将其专利ZL201810920417.8登记在了专利信息登记平台上。
实施办法并未限制仿制药MAH登记其药品相关专利,因此百奥公司的登记没有问题。实施办法第六条中“针对被仿制药每一件相关的药品专利作出声明”,“被仿制药”是具有通用名的药品缬沙坦氨氯地平片(I),还是Novartis公司的原研药缬沙坦氨氯地平片(I)?如果是前者,不区分MAH,ZL201810920417.8显然是“相关的药品专利”。如果是后者,原研药企之外的第三方的专利是否是“相关的药品专利”?
另一个仿制药申请人石家庄四药有限公司,针对该药品作出了1类声明,载明的MAH是Novartis公司。不过有趣的是,该1类声明作出日早于ZL201810920417.8的专利信息登记公开日2天。石家庄四药有限公司的声明没有问题。
那么问题在于,辰欣公司以及今后该药的仿制药申请人应当如何作出专利声明?目前的4.2类声明是否应当通知MAH?通知Novartis公司还是百奥公司?百奥公司得知并对该4类声明有异议的,能否向法院起诉或向国务院专利行政部门请求行政裁决?
布洛芬混悬液存在类似的情形。翔宇药业股份有限公司(以下简称“翔宇公司”)并非原研药企,但专利登记平台上仅有翔宇公司登记的ZL201310347985.0。百奥公司以翔宇公司为MAH,作出了4.2类声明。而新华制药(高密)有限公司在其之后,以上海强生制药股份有限公司为MAH,作出了1类声明。两者谁对谁错?或者都对或都错?
4、MAH基于声明依据方可确定后续策略
江苏豪森药业集团有限公司针对达格列净片作出的4.2类声明,在备注中注明了“组合物的API与该专利不同”,其余的4.2类或4.1类声明并无相应备注。
MAH只有收到声明依据后才能得知具体理由,并决定后续策略。毕竟《关于审理申请注册的药品相关的专利权纠纷民事案件适用法律若干问题的规定》(以下简称“司法解释”)第十二条中规定,专利权人或利害关系人知道或应当知道其主张的专利权应当被宣告无效,仍提起专利法第七十六条所称诉讼或者请求行政裁决的,药品上市许可申请人可以提起损害赔偿之诉。
5、能否基于被宣告无效的专利启动纠纷早期解决机制?
盐酸鲁拉西酮片的两个登记专利于2020年底被国家知识产权局宣告无效,请求人是郑红艳。浙江华海药业股份有限公司并未作出2类声明,而是作出了4.2类声明,可能出于对专利权的有效性仍存在担忧,而更相信其仿制药未落入相关专利权保护范围。
由此引发的后续问题是,在两个专利均被宣告无效的情况下,如果已如期提起行政诉讼,Sunovion Pharmaceuticals Inc.(以下简称“Sunovion公司”)能否基于被宣告无效的专利启动纠纷早期解决机制?《关于审理侵犯专利权纠纷案件应用法律若干问题的解释(二)》第二条规定了在专利侵权诉讼中主张的权利要求被宣告无效专利的,对于基于该无效权利要求的起诉可以先行裁驳,另行起诉。但纠纷早期解决机制毕竟不是侵权之诉,能否类推适用?
《药品专利纠纷早期解决机制行政裁决办法》第十条明确规定,“涉案专利所涉及的权利要求被国家知识产权局宣告无效的”,不予受理。司法解释中并无明确规定,只是在第十二条中引入了败诉反赔规定。从文意理解,似乎Sunovion公司只要甘于承担败诉反赔的风险,至少可以就申请上市药品的相关技术方案是否落入相关专利权保护范围向法院起诉。这一点,需要司法实践确认。
三、其他相关问题的快速回答
1、专利声明作出后多久可以在平台公开
基于持续观察,专利声明最快在声明受理日期当天就会在平台公开。当然这个时间有快有慢,慢的4-5天,甚至更长。
2、仿制药上市申请多久会被受理
经核实,仿制药上市申请最快在声明受理日期当天会被药监局药品审评中心(CDE)承办,并在CDE官网公开,说明仿制药上市申请已经被药监局受理。整体来看,仿制药上市申请的专利声明受理日期与ANDA被受理的时间间隔大多数是一两天,个别的会间隔五六个自然日。
3、MAH多久可以获知专利声明
按照实施办法的规定,仿制药申请被受理后10个工作日内,仿制药申请人应当将相应声明及声明依据通知MAH。如果仿制药申请人在第10个工作日通过邮件和纸质信函途径通知MAH,考虑到MAH或登记邮箱联系人可能还需转通知专利权人,距离CDE公开药品上市许可申请之日可能已过去十多天,原本就不宽裕的45天窗口期就又被大大压缩了。
因此,对于MAH,最好的选择是保持对登记平台的实时关注。
4、仿制药申请人会不会不提交专利声明
不会。2021年7月4日,国家药监局关于实施《药品专利纠纷早期解决机制实施办法(试行)》相关事宜的通告(2021年第46号)中规定,即日起,申请人提交化学仿制药、中药同名同方药、生物类似药上市注册申请时,应当对照已在中国上市药品专利信息登记平台公开的相关药品专利信息,按实施办法要求提交专利声明,并将声明及声明依据通知上市许可持有人。未提交专利声明的,补正后方予以受理。
实施办法中规定的这四类声明,已经涵盖了所有可能的情形,仿制药申请人应当从中择一作出。
四、结语
不积跬步,无以至千里。对药品专利链接这个崭新制度,所有人都在摸索前行。行进中跌倒了不怕,怕的是因为担心跌到而不敢前行。对于这个制度,我们需要抱有宽容之心,大胆去尝试,终能行稳致远。
(图片来源 | 网络)



















