9月口审动态 | 艾伯维维奈克拉、派格生物在研新药PB-119等遭遇专利挑战
以下为截至发稿前近日专利复审委已公布的9月涉药品专利口审公告信息。
更多近期复审委公告盘点,详见下方链接:
7月复审委公告盘点 | 帕妥珠单抗、达格列净等药品专利挑战加速
7月复审委公告盘点(二)| 托珠单抗 、德谷胰岛素,生物类似药布局加速
*信息来源:知产宝药品专利链接数据库、知产宝专利数据库、国家药监局、FDA、Google Patent 等公开检索渠道。
整理 | IvesDuran
01
艾伯维BCL-2抑制剂维奈克拉片
急性髓系白血病

口审信息概览
专利号:201510165051.4
专利名称:用于治疗癌症和免疫和自身免疫疾病的细胞程序死亡诱导药剂
专利权人:艾伯维爱尔兰无限公司
无效宣告请求人:侯晓菲
口审日期:8月29日

专利信息概览
专利申请日:2010年5月26日
授权公告日:2017年6月23日
本发明涉及用于治疗癌症和免疫和自身免疫疾病的细胞程序死亡诱导药剂,涉及抑制Bcl-2抗凋亡蛋白的活性的化合物、含有该化合物的组合物和治疗疾病的方法,在该疾病期间,抗凋亡Bcl-2蛋白被表达。

针对该件专利,苏州亚盛药业有限公司曾于2021年7月26日递交了无效宣告请求。
2022年1月27日,合议组做出第53977号审查决定,认定权利要求3的技术方案在说明书中未充分公开,不符合专利法第26条第3款的规定,宣告该发明的权利要求3无效,在权利要求1、2和4的基础上,继续维持该专利有效。
决定要点:
对于说明书已经明确记载不具有其主张的技术效果的化合物,不应给予专利保护。
如果根据说明书充分公开的内容,不能否定权利要求保护的化合物可以解决发明要解决的技术问题,且无相反证据能够证明权利要求保护的化合物不能达到所述技术效果,则不能断言所述权利要求未得到说明书支持。
原说明书和权利要求书记载的范围包括原说明书和权利要求书文字记载的内容和根据原说明书和权利要求书文字记载的内容以及说明书附图能直接地、毫无疑义地确定的内容。如果结合上下文,能够确认一篇文献中公开的化合物名称是错误的,那么本领域技术人员不会将该错误名称作为该文献公开的内容。
在判断创造性时,首先要将权利要求保护的技术方案和最接近的现有技术进行对比,找出二者的区别特征,确定权利要求所述技术方案实际解决的技术问题,进而考察现有技术中是否存在将该区别特征引入到所述最接近的现有技术中以解决上述技术问题的启示,如果现有技术中不存在这样的启示,则该权利要求具备创造性。

扫描上方二维码,
获取第53977号审查决定

涉案药品信息
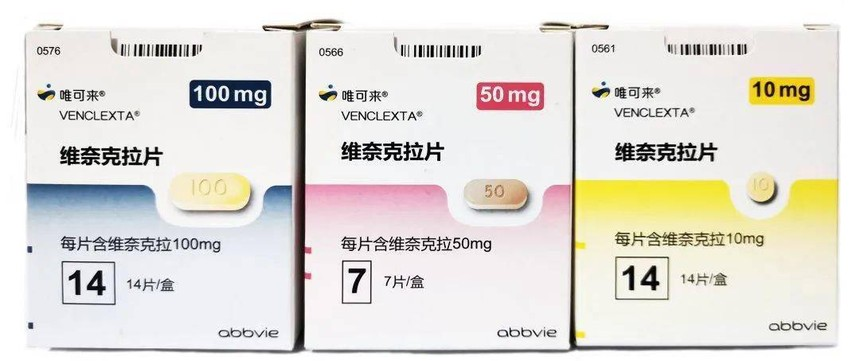
药品名:维奈克拉片(Venetoclax Tablets)
商品名:唯可来(VENCLEXTA)
适应症:急性髓系白血病
维奈克拉是全球首个Bcl-2选择性抑制剂药物,也是全球唯一获批上市的针对细胞凋亡机制药物。Bcl-2(B细胞淋巴瘤因子-2)能帮助癌细胞活的更久,是大多数血液肿瘤的主导致癌基因,而在急性髓系白血病(AML)患者检查报告中,还有一些其他基因突变增加了治疗难度。但维奈克拉可以跨越这种屏障,直接作用于Bcl-2并起到抑制作用。
2016年4月,该药获美国FDA 批准用于治疗慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL),现已在全球50多个国家/地区上市。
2020年1月,艾伯维向国家药监局递交了维奈克拉片用于治疗急性髓系白血病适应症的上市申请,该药通过优先审评通道于同年12月获批上市。
目前,国内已有百济神州、复星医药、亚盛药业和广州麓鹏制药四家药企布局 Bcl-2 靶点。
其中,亚盛药业研发的APG-2575是国内首个进入关键注册临床阶段且具有明确疗效的Bcl-2选择性抑制剂,正在全球范围内开展涉及多个血液肿瘤和实体瘤适应症的临床试验。

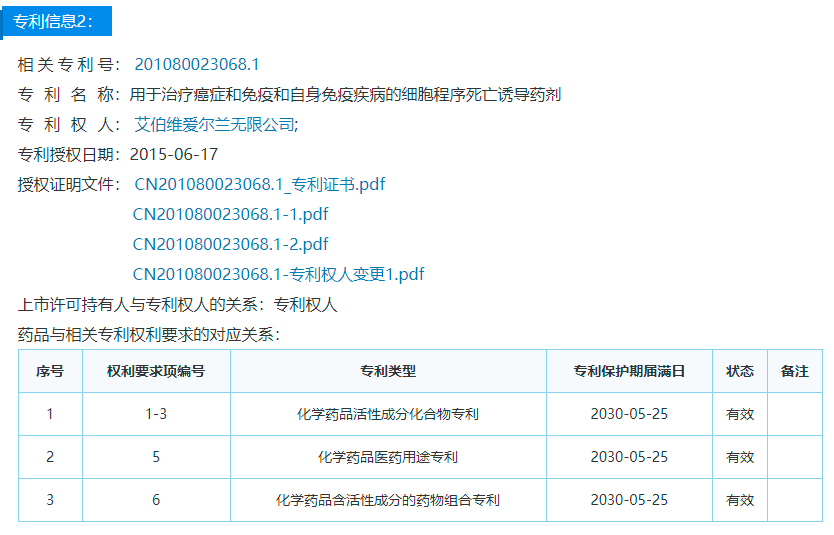
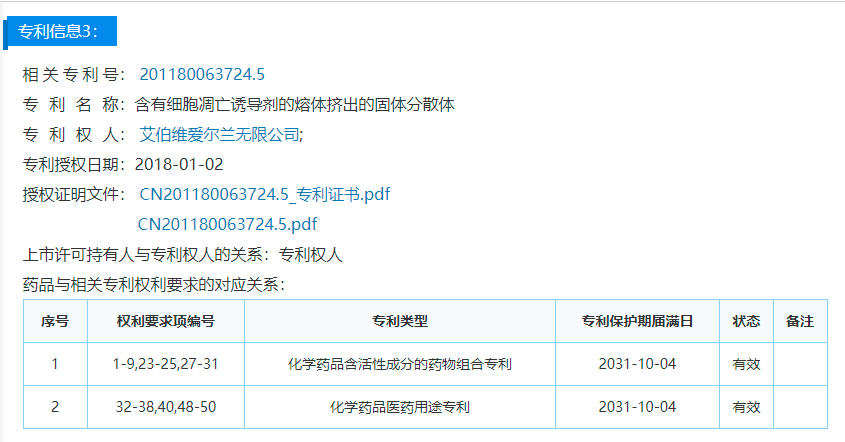
中国药品专利公示信息
除了本次被提起无效宣告的专利,针对维奈克拉片,艾伯维还在药监局公示了两件药品专利。具体信息如下:
02
科瑞德药业 橼酸坦度螺酮胶囊
抗焦虑症

口审信息概览
专利号:201710017545.7
专利名称:一种氮杂螺酮类药物组合物及其制备方法
专利权人:四川科瑞德制药股份有限公司
无效宣告请求人:李家喜
口审日期:8月30日

专利信息概览
专利申请日:2017年1月11日
授权公告日:2021年9月17日
专利说明书显示,坦度螺酮属于氮杂螺酮类药物,是一种5-羟色胺受体激动剂,属于第3代抗焦虑药,主要用于治疗焦虑或其他伴焦虑状态的疾病。相较于其同类衍生物丁螺环酮,坦度螺酮具有更高的选择性抗焦虑作用。
专利发明人发现,控制枸橼酸坦度螺酮的质量,对降低枸橼酸坦度螺酮的不良反应发生率、提高其抗焦虑和抗抑郁效果具有重大的意义。

涉案药品信息

药品名:枸橼酸坦度螺酮胶囊
商品名:律康
适应症:各种神经症所致的焦虑状态,如广泛性焦虑症;原发性高血压、消化性溃疡等躯体疾病伴发的焦虑状态。
批准日期:2020年3月30日
被仿原研药企:住友制药
目前,原研住友制药获批的是坦度螺酮片剂,商品名“希德”。该仿制药现仅有四川科瑞德获批生产销售,剂型为胶囊剂。另有,兰西哈三联制药、北京颐康兴医药、北大医药等企业布局仿制。
03
派格生物 PB-119在研项目
2型糖尿病、肥胖症

口审信息概览
专利号:201080018053.6
专利名称:Exendin变体及其缀合物
专利权人:派格生物医药(苏州)股份有限公司
无效宣告请求人:荣治国
口审日期:9月7日

专利信息概览
专利申请日:2010年4月23日
授权公告日:2013年10月9日
本发明提供了一种新型的Exendin变体以及其上缀合了聚合物的Exendin变体缀合物,含有它们的药物组合物以及它们在治疗疾病比如降低血糖、治疗糖尿病尤其是Ⅱ型糖尿病中的用途。本发明还提供了Exendin缀合物在降低体重中的用途。

涉案药品信息(在研)

招股书显示,涉案专利涉及派格生物研制的用于治疗2型糖尿病1类长效GLP-1受体激动剂PB-119。该药具有有效控制血糖和减少糖尿病并发症发生率;降低患者体重、改善胰岛β细胞功能;减少给药频率、提高患者依从性等特点。PB-119已获国家重大专项支持,目前在中国和美国同步进行Ⅱb期临床试验。

2011年1月10日,针对PB-119研发项目,派格生物与江苏豪森药业股份有限公司等达成专利实施许可。派格生物就此获得豪森药业“修饰的Exendins及其应用”专利(专利号:ZL200680000411.4)的实施许可,许可期限至该专利权届满日。
2022年4月12日,由于发行人撤回发行上市申请或这保荐人撤销保荐,上交所终止了派格生物的发行上市审核。
04
诺和诺德 vs 惠升生物
胰岛素

口审信息概览
专利号:200680053516.6
专利名称:包含酰化胰岛素和锌的组合物以及制备所述组合物的方法
专利权人:诺沃-诺迪斯克有限公司
无效宣告请求人:吉林惠升生物制药有限公司
口审日期:9月8日

专利信息概览
专利申请日:2006年12月21日
授权公告日:2012年10月10日
本发明涉及具有高锌原子含量/6分子酰化胰岛素的胰岛素组合物。本发明胰岛素是酰化胰岛素,可与速效胰岛素Asp B28人胰岛素等其它胰岛素类似物相混合。
据报道,惠升生物是四环制药附属公司,其研发的第四代胰岛素类似物德谷胰岛素注射液的新药上市申请(NDA)已获得中国国家药品监督管理局受理。这是继原研产品诺和达之后,第一个在国内进行新药上市申请并获得受理的国产第四代胰岛素类似物德谷胰岛素。
值得一提的是,这不是惠升生物于诺和诺德之间围绕胰岛素相关药品专利的第一次交手。在此之前,惠升生物曾就诺和诺德“新型胰岛素类似物”专利发起挑战,该专利涉及诺和诺德研发的德谷胰岛素。目前该专利无效审查决定结果未知。
相关信息详见:
7月复审委公告盘点(二)| 托珠单抗 、德谷胰岛素,生物类似药布局加速
(图片来源 | 网络)



















