浅议药物晶型创造性及使用公开的认定
-----也评甲磺酸阿帕替尼晶型无效案例
作者 | 梁宝龙
(本文系知产力获得授权的稿件,转载须征得作者本人同意,并在显要位置注明文章来源。)
(本文4735字,阅读约需9分钟)
医药领域最近一直都是热闹非凡,此起彼伏。接连不断的专利纠纷也让小伙伴们一个个目不暇接。上海宣创诉江苏恒瑞阿帕替尼晶型侵权案以及随之而来的江苏恒瑞请求宣告上海宣创涉诉专利无效案又吸引着不少好奇的眼神。笔者作为入行不深的菜鸟,根据毛主席“在战争中学习战争”的教导,本着在“在无效中学习无效”的目的,迫不及待地将新鲜出炉的复审委第33126号无效宣告请求决定书细细品读。
俗话说:师出有名才能名正言顺,辞正理顺才能让人心服口服。行政决定的公正不仅包括最终结果的公正,也应当包括程序和过程的公正。笔者在此不站队,不结盟,也不探讨最终结果的客观性和当事双方的是否曲折,但就研读无效决定书中对晶型创造性的认定依据和使用公开的认定产生的部分疑问提出自己的一点浅浅的意见提出来探讨,也借此抛砖引玉,希望业内大咖不吝赐教。
一、关于晶型创造性判断的认定依据
创造性是药物晶型无效中普遍考虑的重要策略,也是无效程序中最容易采用的理由,其重要性可想而知。而晶型创造性的认定依据则是判断其创造性的重要一环,也是其认定过程必须考虑的依据。而阿帕替尼无效决定书认定其甲磺酸盐A晶型创造性的依据为:对于结构上与已知化学产品接近的化学产品,只有在其相对于已知化学产品产生预料不到的用途或效果的前提下,该化学产品才具备创造性;反之,则不具备创造性[1]。各位看官是否对该依据的表述很耳熟?其不仅经常出现在晶型的无效决定中,而且也出现在最高法的行政诉讼裁定书中作为判断晶型创造性的依据[2]。更是现在晶型专利实审意见的标配,但你很可能找不到这句话作为晶型创造性判断依据的法律依据。耳熟的另外一个重要的原因在于其余审查指南的有关规定高度相似。
审查指南的规定:“对于结构上与已知化合物接近的化合物,必须要有预料不到的用途或效果,否则该化合物不具备创造性。”这是审查指南关于化合物创造性的判断依据和规定。该规定基于化合物的构效关系而设定的,而且对“结构接近的化合物”的认定也是以化合物与已知化合物在结构上存在区别特征为前提条件,因为与已知化合物结构相同的化合物不具有新颖性,其创造性更无从谈起。因此将化合物专利分别按照结构相近或不相近而设定不同的审查标准和要求,符合本领域技术人员的知识背景和通常认知。而该无效决定是依据“对于结构上与已知化学产品接近的化学产品,必须要有预料不到的用途或效果,否则该化学产品不具备创造性”。但无论专利法及其实施细则还是多个版本的《专利审查指南》均没有上述规定的原文和记载。通过对比可知,该无效决定的依据实际上是将前述化合物专利审查标中的概念“已知化合物”替换为“已知化学产品”。审查指南在第十章《关于化学领域发明专利申请审查的若干规定》中3.1化学产品发明的充分公开一节明确指出,化学产品包括化合物和组合物[3]。由此可见,无效决定采用的“已知化学产品”概念并不等同于审查指南中“已知化合物”,而是高于化合物这一概念的更上位概念。这种概念的替换改变原有的法律本义,人为地扩大了该规定的适用范围,违背了依法行政原则,将使得无效决定在逻辑和依据上产生瑕疵,其合法性也势必受到质疑。至于药物晶型创造性应当如何认定的问题,暂不探讨。
二、关于阿帕替尼甲磺酸片使用公开的认定
为主张涉案专利保护的A晶型已经在先使用公开,请求人提交了“某医甲磺酸阿帕替尼临床应用评价分析”的期刊杂志[4],并在其弟2139页左栏第一段及右栏第一段记载如下内容:
甲磺酸阿帕替尼(apatinib,阿帕替尼)是一种针对血管内皮生长因子受体-2(VEGFR-2)的小分子酪氨酸激酶抑制剂,于2014年12月13日获得国家食品药品监督管理总局批准用于治疗晚期胃癌,是胃癌靶向药物中唯一一个可以口服制剂,不但可提高患者的依从性,也可以降低治疗费用在一项随机双盲对照期临床试验[1]中,阿帕替尼可显著延长胃癌或食管癌患者的中位无进展长存期(PFS)虽然目前仅胃癌是阿帕替尼有证据的适应证,但涉及多种肿瘤的临床试验正在进行,包括转移性三阴及非三阴乳腺癌非小细胞肺癌肝癌等[2-8]为提高临床用药合理性及药物使用安全性,现对某院2015年4月~2016年3月期间阿帕替尼使用情况进行回顾性调查分析,为临床合理用药提供参考。
对某院2015年4月~2016年3月期间阿帕替尼使用情况进行回顾性调查分析”以及“利用医院计算机信息系统(HIS),调取2015年4月~2016年3月使用阿帕替尼的患者及相关信息(商品名:艾坦,江苏恒瑞医药股份有限公司,批准文号国药准字H20140105,规格:0.425g),制定表格统计患者的病理类型诊断用法用量不良反应等信息,与阿帕替尼说明书及NCCN临床实践指南(简称指南)进行比较分析其临床应用合理性,并对该药的安全性进行评价。
合议组据此认为:①上市许可批准时间不代表实际销售,甲磺酸阿帕替尼于2014年12月13日获得批准,不代表批准即发生销售。②虽然证据2记载了2015年04月-2016年3月期间曾在某医院进行临床使用,但并未说明是否通过公开销售渠道获得,因而不能认为是艾坦公开销售的时间。③关于使用公开,某医院使用阿帕替尼114例次,属于临床试验,即便公开进行,医师或药师通常并不会对药品进行检测已获取其中相关药物成分除说明书以外的结构信息,接受治疗的患者跟无对药物进行检测的可能性,因而不构成专利法意义上的使用公开,不能破坏涉案专利的新颖性。目前虽然多篇关于该无效决定评论,但大都与决定书的意见一致。笔者在此不能完全认同,特在此提出,与大家一起探讨。
1、关于甲磺酸阿帕替尼的上市时间
正如无效决定书所述,证据的真实性既包括形式上的真实性身材,也应当包括证据内容的真实性审查。虽然证据2记载了甲磺酸阿帕替尼于2014年12月13日获得国家食药总局的批准用于治疗晚期胃癌;但是实际上,江苏恒瑞的阿帕替尼片并非2014年12月13日才获得批准。根据国家食品药物监督管理局(CFDA)公开的数据显示,证据2中使用的批准文号国药准字H20140105、规格为0.425g的“艾坦“早在之前的2014年10月17日就获得上市许可,并于2014年11月13日获得新药证书和注册批件[5]。
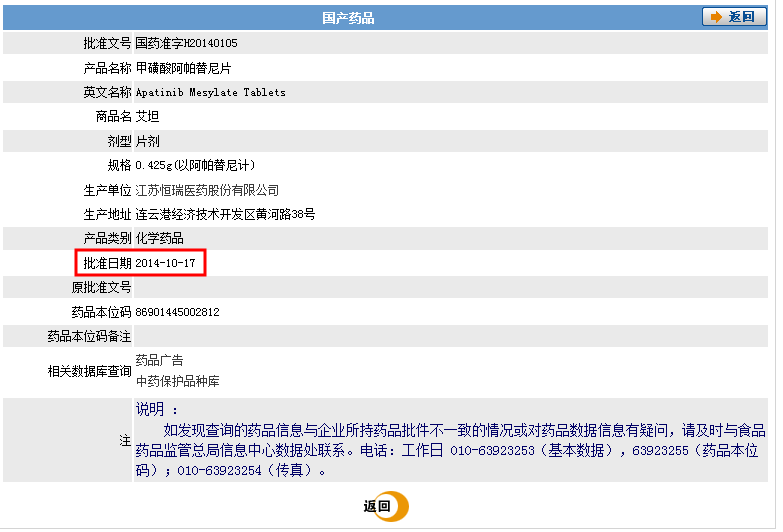
笔者同意合议组关于获得上市许可不等于即刻上市的观点。但也并非上市时间毫不可查。虽然关于阿帕替尼上市时间的具体时间新闻报道的时间不一,但是江苏恒瑞医药股份有限公司于2015年3月31日在上海证券交易所网站公开的“2014年年度报告”中明确记载“创新药阿帕替尼成功上市”、“创新药阿帕替尼于年底成功上市”、“创新药艾瑞昔布和阿帕替尼已获批上市”[6],因此根据该公开的证据至少可以确定阿帕替尼在2014年12月31日前已经上市,即已经公开销售。而且该报告的公开日早于涉案专利的申请日2015.07.08,。
另外,从该证据2公开的内容可以得出以下内容:(1)证据2已明确记载使用的药品为江苏恒瑞医药股份有限公司生产、商品名为“艾坦”、并具有确定的规格和批准文号,说明某医院使用的药品为国家药品批准以后生产的药品、且完全具有和符合上市药品的包装外观。(2)该证据2的标题即为“某院甲磺酸阿帕替尼临床应用评价分析”,并明确记载了阿帕替尼的使用情况进行分析,而且其在3.1记载了“超说明书适应症以外的临床应用分析”,且提供的表1也明确记载为“阿帕替尼临床应用情况调查”。这种“临床使用”或“临床应用”,按照本领域技术人员的一般理解,应当是指医院或医师根据诊断结果将已经上市的药物公开用于疾病的治疗,而非临床试验;(3)从其表1提供的临床应用情况看,使用艾坦的患者的诊断病症涉及肉瘤、肺癌、肝癌、乳腺癌、结直肠癌、胃癌、乙肝、丙肝、宫颈癌等十种病症,说明该医院临床应用阿帕替尼没有确定的适应症,并非开发第二适应症临床试验;因为该药品已经审批,更不可能是上市前的临床研究。相反,该用药统计病症的多样性更说明该结果应该是医院面对来自非特定病者患者的诊断及其用药。(4)在“艾坦”已经被批准上市且没有证据证明某院与生产厂家存在特定关系的情况,可以合理推断该药品是通过正常的商业渠道购买得到。(5)无效程序中认定事实应当参照适用民事诉讼中的高度概然性证明标准[7],只要证据能够证明的事实很可能那样即可,不需要达到到确实、充分、排除其他可能性的程度。
由此可见,根据证据2公开的信息可以合理推断,某院使用“艾坦”进行临床使用或应用,是公开的、正常使用上市药品用于治疗疾病的行为,而非临床试验。进而合理推断甲磺酸阿帕替尼在2015年04月-2016年3月期间及以前已经上市销售。相反,该证据2自始至尾没有关于“2015年04月-2016年3月期间曾在某医院进行临床使用”是临床试验的记载,对于合议组认为证据2所述的临床应用分析是临床试验的观点不敢表示认同,其也没有在决定书给出认定依据。
2、关于使用公开的认定
根据审查指南的规定,由于使用而导致技术方案的公开,或者导致技术方案处于公众可以得知的状态,这种公开方式称为使用公开。使用公开的方式包括能够使公众得知其技术内容的制造、使用、销售、进口、交换、馈赠、演示、展出等方式。只要通过上述方式使有关技术内容处于公众想得知就能够得知的状态,就构成使用公开,而不取决于是否有公众得知。如果使用公开的是一种产品,即使所使用的产品或者装置需要经过破坏才能够得知其结构和功能,也仍然属于使用公开。
而对于证据2某院临床使用艾坦,合议组认为,医师或药师通常并不会对药品进行检测以获取其中相关药物成分除说明书以外的结构信息,接受治疗的患者更无对药品进行检测的可能性。即使该临床应用[8]是公开进行的,相关人员也不会因临床使用而得知艾坦中甲磺酸阿帕替尼的晶体结构信息,因此本领域技术人员通过该临床使用无法得知艾坦中甲磺酸阿帕替尼的晶体结构信息。
笔者在此想说的是,(1)该专利属于药物晶型技术领域,医师或药师以及患者属不属于本领域技术人员尚需斟酌探讨;况且本领域技术员的范围除前述人员之外至少还应当包括药物晶型制备技术人员和药物晶型分析测试人员,因此仅由医师、药师、患者无法获取药物组分的结构信息推导出本领域技术人员无法得知前述结构信息的结论,从逻辑上看,着实有些勉强。(2)医师或药师通常不会对药物检测,不代表在“通常”之外会对药物晶型进行检测的可能性。更没有任何证据证明接受治疗的患者没有对药物检测的可能性,万一有个患者是具有很强好奇心的本领域技术人员呢?(3)使用公开考虑的获知对象是公众,且所述“公众”并不限定技术领域,而非本领技术人员。因此以“本领域技术人员无法得知”来替代“公众无法得知”来推断具有新颖性是缺乏法律依据的。(4)使用公开并不要求公众(暂且包括医师、药师、患者)或有人是否实际已经获知药物成分的结构信息,而是要求能不能得到。只要处于公众能够得知的状态,即可认定使用公开。再退一步讲,只要能够证明现有技术可以通过测定或者药品中的晶型,即可认为公知可以获知,而不管其是否有动机去获知。因此,通过上上述分析,无效决定书对使用公开的认定在推导逻辑上也有所欠佳。
本人入行不深,道行较浅,不对无效决定的结论做任何评价,就研读中对结论的推理依据和过程的疑问提出自己一点点意见与大家谈谈,不对之处望大家指正,如有冒犯,还望各位海涵。
注 释:
[1]专利复审委第33126号无效决定书:二、决定理由和依据,5.关于专利法第22条第3款;
[2]最高人民法院(2011)知行字第86号行政裁定书,中国裁判文书网;
[3]2010年版《专利审查指南》中化学产品还包括“用结构或组成不能够清楚描述的化学产品”。
[4]即证据2:《中国医药杂志》,2016年12月第51卷第24期,第2139-2142页;
[5]江苏恒瑞医药股份有限公司关于阿帕替尼获得国家1.1类新药批件及证书的公告,上海证券交易所网站:http://www.sse.com.cn,2014.11.05;
[6]江苏恒瑞医药股份有限公司2014年年度报告:第6-7及12页,上海证券交易所上市公司公告,http://www.sse.com.cn,2015.3.31;
[7]《专利审查指南》第四部分第八章1.引言;
[8]无效决定书在此处的表述为“临床试验”,笔者不认同该性质认定,故使用证据2中的表述“临床应用”;



















