肺癌靶向药泰瑞沙被判侵权惠氏,阿斯利康暂落下风
作者 | 宋明 冯欢 侯广 北京桓润律师事务所
编辑 | 布鲁斯
2024年5月28日,美国特拉华联邦地区法院依据陪审团裁决发出非终局判决(non-final judgment),关于Puma生物科技(Puma)和辉瑞全资子公司惠氏(Wyeth)起诉阿斯利康案,判决专利侵权成立,阿斯利康需赔偿1.075亿美元。这场围绕重磅肺癌药物奥希替尼(英文名:Osimertinib;商品名:泰瑞沙/Tagrisso®)的较量只是刚刚开始。
案件经纬
本案涉及耐药性非小细胞肺癌疗法的两项专利:314号专利(美国专利号10,603,314,授权日2020年3月31日)和162号专利(美国专利号10,596,162,授权日2020年3月24日)。两项专利均由惠氏及案外人通用医疗公司(General Hospital Corporation)共有,但后者已于2006年将其权利授予惠氏。惠氏在2011年将上述专利相关的化合物来那替尼(Neratinib)实施权许可给Puma公司。
2021年9月22日,Puma联合惠氏起诉了阿斯利康,请求判令阿斯利康对非小细胞肺癌药Tagrisso®的生产经营行为“故意”侵害涉案专利。审理中,Puma因仅拥有来那替尼的权利而被从原告主体中排除,后续诉讼进程在惠氏和阿斯利康之间进行。
非小细胞肺癌的治疗良药
奥希替尼作为第三代肺癌靶向药,是阿斯利康的重磅肺癌药物。今年公布的阿斯利康2023年财报显示,该药去年在全球总销售收入高达58亿美元,仅低于该公司治疗糖尿病和心衰的达格列净(59.6亿美元),经济效益巨大[1]。
肺癌主要分为小细胞肺癌和非小细胞肺癌,其中非小细胞肺癌占到85%[2]。表皮生长因子受体(缩写EGFR)是肿瘤中经常突变的一个重要基因。围绕EGFR基因的突变,开发了非小细胞肺癌一代靶向药吉非替尼(Gefitinib)和厄洛替尼(Erlotinib)。
后来,阿斯利康开发出解决吉非替尼和厄洛替尼耐药性的第三代靶向药奥希替尼,获得了极大成功,被视为肺癌患者的救命稻草[2]。
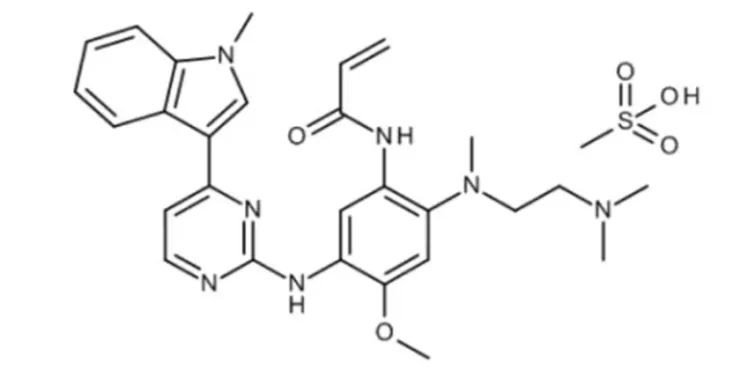
奥希替尼
临床上,耐药性的产生可能是在某些基因的位点发生特定的突变造成的,这样的突变称为耐药突变。患者经历吉非替尼和厄洛替尼治疗后,经常在EGFR基因的20号外显子第790位点发生蛋氨酸取代苏氨酸的耐药突变(T790M突变),对上述两种药物不再响应。
吉非替尼和厄洛替尼是临床一线治疗药物,两者均属于可逆性表皮生长因子受体酪氨酸激酶抑制剂(缩写TKI)。奥希替尼则属于不可逆性TKI,通过共价键与作用位点结合。
根据阿斯利康的宣传册,奥希替尼具体结合的作用位点包括了EGFR突变:T790M\L858R和外显子19缺失[2]。
从权利要求可以看到,第314号专利要求保护的治疗方法,针对发生吉非替尼和厄洛替尼耐药的非小细胞肺癌患者使用不可逆TKI抑制剂,所述抑制剂以共价键与EGFR的配体结合口袋中的半胱氨酸773、或erb-B2的配体结合口袋中的半胱氨酸805结合,第162号专利在第314号专利方案的基础上进一步限定所述非小细胞肺癌患者具有T790M突变。

第314号专利

第162号专利
奥希替尼使用了不可逆TKI抑制剂来治疗吉非替尼和厄洛替尼耐药的非小细胞肺癌(含T790M突变)。
题述专利侵权案件中,原告主张,被告制造、使用、许诺销售、销售、进口奥希替尼及Tagrisso®制剂(Tagrisso®产品)的商业行为构成侵权。
抗辩与争议
阿斯利康基于Puma和惠氏的起诉主体不成立请求驳回起诉,并提出多项抗辩主张,例如包括:涉案专利无效;不侵权抗辩;不应承担专利授权前损害赔偿;非故意侵权等,并相应地提交了多个简易判决动议。
基于截至目前的法院令,Puma的起诉被驳回,阿斯利康关于不应承担专利授权前损害赔偿及非故意侵权的简易判决动议被批准,其他动议被否决[4]。
我们注意到一部分争议在诉讼中尚未得到解决,这些争议围绕阿斯利康提出的无效理由,如权利要求是否覆盖全类型的不可逆TKI抑制剂、是否覆盖全类型的非小细胞肺癌、特定化合物的排除使得本领域技术人员的实施需要过多实验等。
2024年6月起,美国联邦地区法官马修·肯尼利(Matthew Kennelly)将就阿斯利康的其余抗辩进行审理,后续审理是否推翻或修改目前的非终局判决,尚未可知。
充分公开和支持
阿斯利康提出的抗辩理由涉及多方向,本文围绕充分公开和支持要求问题进行讨论,其余部分不作展开。
充分公开和支持要求在中国主要涉及专利法第二十六条第三款、第二十六条第四款。在美国则主要涉及美国专利法(AIA) 35 U.S.C. 112(a),包括“书面描述”(written description)和“能够实现”(enablement)。美国联邦巡回上诉法院近期多次以该两项理由判定专利无效。
“The specification shall contain a written description of the invention, and of the manner and process of making and using it, in such full, clear, concise, and exact terms as to enable any person skilled in the art to which it pertains, or with which it is most nearly connected, to make and use the same, and shall set forth the best mode contemplated by the inventor or joint inventor of carrying out the invention”. (AIA)35 U.S.C. 112(a)
“能够实现”要求说明书的内容足够使本领域技术人员实施发明,而无需过多的实验,倾向于“该发明能被使用”。“书面描述”要求说明书充分详细地描述发明,倾向于证明“拥有该发明”。特别地,当涉及保护一类物质的权利要求时,“书面描述”要求给出代表性数量的实施例,以证明在整个范围中发明都能实现(Id. (quoting Ariad Pharms., 598 F.3d at 1350).)。
在上述未解决的争议中,涉案专利的说明书给出了抑制剂的3个实施例,一个实施例中,受试者的肿瘤不具有指示吉非替尼和/或厄洛替尼敏感性的突变,但具有指示吉非替尼抗性的突变。
“能够实现”方面,涉案权利要求中提出“一种治疗方法,……不可逆TKI抑制剂……”意味着只要一个物质属于不可逆TKI抑制剂就会落入该范围中,阿斯利康认为在说明书中记载的全部物质并不能都作为不可逆TKI抑制剂使用,例如记载了“更大的化合物”但更大的化合物因为无法进入胞内结合位点,实际上并不能实用;而作为不可逆TKI抑制剂,其含义涵盖了大量物质,除了本说明书描述的特定类型的反应剂(迈克尔受体),还包括其他活性剂如环氧化物等,但这些并没有记载在说明书里。类似地,对于被治疗的非小细胞肺癌的范围也有争议。
“书面描述”方面,涉案权利要求中提出“一种治疗方法,……不可逆TKI抑制剂……”。“不可逆TKI抑制剂”是一个通用的功能性描述,没有包括对该物质的结构的限制,因此需给出适当数量的实例,使得本领域技术人员能够根据优先权日的技术水平判断一个物质是否属于“不可逆TKI抑制剂”、或构想出“不可逆TKI抑制剂”应该是什么样的。阿斯利康主张这三个实施例“非常相似”,因此说明书不满足“适当数量的实例”,不满足“书面描述”的要求。
因此,涉案专利是否满足了“能够实现”和“书面描述”,将影响本案专利是否被无效。
一个以缺乏书面描述为由无效成功的案例是朱诺(Juno)-凯特(Kite)案。2021年,美国联邦巡回上诉法院判决朱诺的190号专利(美国专利号7,446,190)部分无效[5]。
CAR-T细胞是现在细胞疗法的热点,并被认为是非常有希望的肿瘤治疗方向。该专利围绕单链抗体可变片段(scFv),该片段能识别特定的肿瘤抗原并与之结合,从而使CAR-T细胞攻击癌细胞。关于“书面描述”,法官认定对于权利要求的CD19特异性scFv,190号专利没有提供代表性的实例或结构特征,使得本领域技术人员能从scFv中区别出能实现所述功能的那些scFv,不满足“书面描述”的要求[5]。具体地,本领域技术人员无法区别哪些scFv是结合CD19的、并且通过这种结合方式能将它们与不结合CD19的scFv明确区分开来。
另一个因不满足充分性被无效成功的案例是再生元案。2020年6月24日,英国最高法院判决再生元的2个专利(欧洲专利 (UK) 号 1 360 287和欧洲专利 (UK) 号 2 264 163)无效。虽然专利声称通过该方法能将小鼠特定基因的可变区替换为人的可变区,但当时的技术只能进行“一小部分”替换,而并不能做到将人的可变区整个替换上去。该院判定,该专利的公开实际上并没有使得能够制造(被替换进小鼠的)人类可变区的程度超过“一小部分”的小鼠,但要求的权利却包括了制造(被替换进小鼠的)人类可变区的程度多得多的小鼠[6],因此是不充分的。
对于充分性的认定,特别地,英国最高法院在该案的判决书中提出了八条关于充分性的法律原则[6],特地强调充分性要求是专利法的“基石”。
该八条主要涉及:
1)专利授予范围要与贡献一致;
2)产品权利要求的贡献是本领域技术人员制备该产品的能力;
3)要求保护的范围不能超过公开的范围;
4)“能够实现”指本领域技术人员将公开内容与优先权日的普通技术知识结合后,要能制备权利要求范围内产品的所有类型或实施例;
5)如本领域人员根据专利公开内容并不能制造该产品,则视为该产品的权利要求超过了其对优先权日现有技术的贡献;
6)并不要求专利权人在公开中展示权利要求范围内每个实施方案都已经测试过和证明有效,可以基于普遍原则,使得看起来合理地认为权利要求范围中的产品都能实施。但要承担风险,如庭审中被证明,该原则实际不足以使得权利要求范围的特定部分在优先权日可实施;
7)满足充分性的权利要求,不会因按照无关紧要的因素(例如,鼠尾巴的长度)将产品权利要求划分到某区域(range)中而被推翻。在整个权利要求范围(scope)可实施指的是在关键区域上可实施,大意是,只有依据显著影响发明目的的参数去划分的区域才是关键的;
8)仅体现出关键区域中的所有产品“一旦被制造出来”就会具有符合发明目的的技术效果,是不足以满足“能够实现”的,不管该发明多么有价值和突破性。
(注:上述概括仅供参考,原文可通过尾注[6]的判决文书获得,请参见该判决书第56条部分)
据此,笔者认为,生物医药类的专利撰写中,为了保证通过公开充分和支持这两条红线,实施例的个数、代表性,及决定权利要求范围的合适措辞都需要仔细斟酌。有限的实施例是否足以证明在申请日当时的技术水平下同类的物质均具有同样的效果,有限的实施例又能否覆盖功能性定义(某抑制剂、激动剂),为此当事人在无效程序中必将“短兵相接、咫尺必争”。
再回到本文主要讨论的Tagrisso案件,特拉华联邦地区法院于2024年5月28日作出的非终局判决包括:
1) 被告阿斯利康侵犯第314号专利的权利要求1、3、9以及第162号专利的权利要求1;
2)被告对上述权利要求并非故意侵权;
3)上述权利要求并非由于因缺少书面说明或可实施性而无效;
4)上述权利要求并非由于可预见或显而易见而无效;
5)基于被告截至2023年12月31日的侵权行为,判赔1.075亿美金。
然而,审理仍在继续,该非终局判决可能会因原被告双方的庭后动议而有所修改,法庭还将继续审理被告后续提出的其他抗辩,如专利无效,以及原告提出的补充赔偿等主张,才能作出终局判决。笔者将与读者共同关注案件进展,尤其是后续程序中对充分公开和支持的裁判意见。
参考文献
[1] 2023年阿斯利康财报,Annual Financial Report in structured electronic format (ESEF) (https://www.astrazeneca.com/investor-relations/annual-reports/annual-report-2023.html);
[2] 阿斯利康制药有限公司甲磺酸奥希替尼片(泰瑞沙®)宣传册,编号CN-98976 有效期至: 2022-12-31;
[3] 奥希替尼/奥西替尼Osimertinib:肺癌患者的救命稻草【医游记】(https://www.sohu.com/a/745614287_121791106);
[4] 美国特拉华联邦地区法院,备忘录意见与法院令,Case No. 21 C 1338, Document 372 日期 03/18/24;
[5] 美国联邦巡回上诉法院,判决,Juno Therapeutics, Inc. v. Kite Pharma, Inc., 2020-1758,2021年8月26 日。
[6] 英国最高法院,判决,Regeneron Pharmaceuticals Inc v Kymab Ltd [2020] UKSC 27 (24 June 2020)。
(本文仅代表作者观点,不代表知产力立场)
封面来源 | 网络 插图来源 | 作者提供



















