追踪百亿级抗精神病药物“鲁拉西酮”仿创之争
作者 | IvesDuran
编辑 | 墨客
当前,精神类疾病是仅次于心脑血管疾病的全球第二大用药领域。而在这一细分领域,最常见的莫过于精神分裂症。
这是一种精神障碍类疾病,包括个人的感知觉、情感与行为异常,能影响多个神经系统,但病因和机制尚未明确。
2019年公开的数据显示,全球有超过2000万人患有精神分裂症。这一数字仍在以一定比例逐年增长。我国,精神分裂症患者数量已接近680万人。
2010年,日本住友制药株式会社(下称住友制药)研发的第二代抗精神分裂症药物——盐酸鲁拉西酮(商品名:Latuda,中文名:罗舒达)首先在美获批上市,并很快成为住友制药旗下“重磅”产品。
公开数据显示,盐酸鲁拉西酮上市以来,年度销售额一度突破126亿元,占据该公司全部药品销售额的40%。
2019年9月,鲁拉西酮在国内正式上市销售,而后被列入国家医保乙类品种。
虽然受到仿制企业竞争的影响,住友制药对于药价做出了一定幅度的降价处理,但2020年,鲁拉西酮的全球销售额仍然攀升至接近20亿美元。
鲁拉西酮组合物专利有效性存疑
原研上市之后,多家国内药企向国家药监局递交了仿制申请。
专利信息公示平台显示,2021年6月,针对盐酸鲁拉西酮片,住友制药公开了两件发明专利,名称均为“药物组合物”,专利号分别为ZL200680018223.4、ZL201010564784.2,两件专利有效期至2026年5月26日。


浙江华海药业股份有限公司(下称华海药业)、石家庄四药有限公司(下称石家庄四药)、辰欣药业股份有限公司(下称辰欣药业),先后递交了盐酸鲁拉西酮的仿制申请,并做出了4.2类专利声明,即仿制药未落入中国上市药品专利信息登记平台收录的被仿制药品相关专利权保护范围。
然而,国知局早在2020年12月就做出了复审决定,宣告住友制药针对鲁拉西酮公开的两件药物组合物专利全部无效。紧接着,住友制药就提起了行政诉讼。专利信息登记平台显示,这两件专利有效性行政诉讼进行中,专利仍处于有效状态。但目前尚未有相关专利行政诉讼与权属纠纷的裁判文书公开。


《关于审理侵权专利权纠纷案件应用法律若干问题的解释(二)》第二条规定:
权利人在专利侵权诉讼中主张的权利要求被专利复审委员会宣告无效的,审理侵犯专利权纠纷案件的人民法院可以裁定驳回权利人基于该无效权利要求的起诉。有证据证明宣告上述权利要求无效的决定被生效的行政判决撤销的,权利人可以另行起诉。
按照文义解释,“先行裁驳,另行起诉”是“可以”而非“必须”。
虽然专利有效性存疑,但笔者了解到,住友制药与几家仿制药企的专利确认不侵权纠纷似乎已经向前推进。
被暂时“打掉”的鲁拉西酮专利
这两件专利是为何在复审阶段被无效?
专利信息显示,这两件组合物专利为PCT专利申请PCT/JP2006/310571。其中,ZL201010564784.2是申请号为ZL200680018223.4的分案申请。2022年11月5日,国知局做出审查决定,两件专利全部无效,无效请求人均为郑红艳。
具体而言,两件专利保护了一种含有鲁拉西酮的口服制剂。不同的是,两件专利的独立权利要求1对鲁拉西酮设定的含量范围不同。且分案专利增加限定了鲁拉西酮的平均粒径范围是0.1~8 μm。
决定要点为,“如果权利要求的概括包含申请人推测的内容,而其效果又难于预先确定和评价,则应当认为这种概括超出了说明书公开的范围,得不到说明书的支持。”
本案中关键的一点是,权利人对活性成分的粒径没有进行特定限定,导致本领域技术人员无法预期制备的制剂具有相似溶出特性,权利要求得不到说明书的支持。
在美国市场,鲁拉西酮原研药也同样遭遇了专利“挑战”。
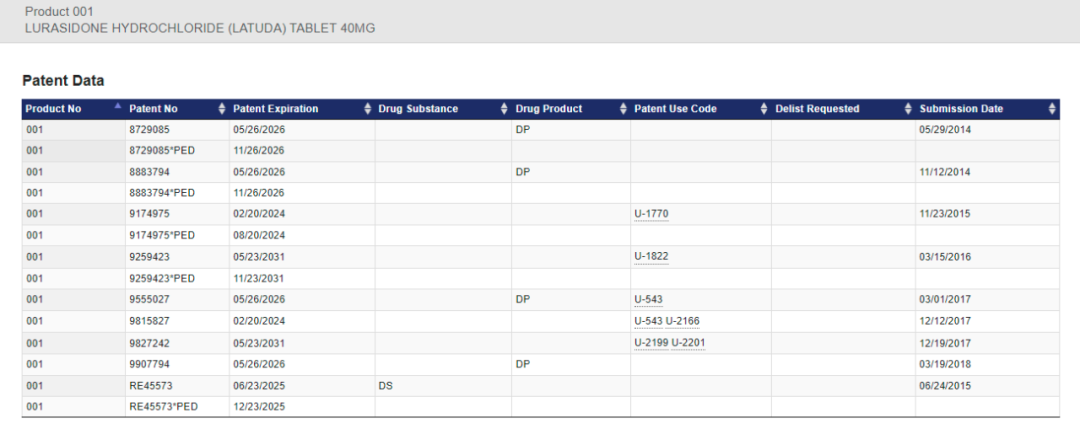
橙皮书数据显示,住友制药的鲁拉西酮自从2010年进入美国市场以来,针对不同剂型的盐酸鲁拉西酮片,陆续申报了多件药品专利。剂型为40mg的鲁拉西酮,公开的专利如上。

其中,橙皮书公开的US9,815,827专利(下称827号专利),描述了一种治疗精神分裂症的新方法,该专利于获得授权,权利有效期至2024年2月20日。
2020年6月5日,仿制药企SlayBack Pharma LLC(译称斯莱贝克制药)向USPTO申请启动双方复审程序,主张该专利不具有可专利性。2021年1月,该案经由专利审判和上诉委员会审理,认定827号专利的75项权利要求因为显而易见而被无效。

详见:
IPR2020-01053,
SLAYBACK PHARMA LLC,v.SUMITOMO DAINIPPON PHARMA CO., LTD.
今年7月,BLoomglaw消息称,针对827号专利,斯莱贝克制药的主张得到了行政法庭的认可,认定827号专利应予无效。
鲁拉西酮专利挑战的后续进展,知产力MED+将持续关注。
部分参考资料:
[1]中国上市药品相关专利信息登记平台已公示专利声明之初体验https://baijiahao.baidu.com/s?id=1709847905798318273&wfr=spider&for=pc
[2]原研药企篇丨药品专利纠纷早期解决机制下企业如何应对http://www.debund.com/article?id=1745
[3]多个重磅首仿药来了:豪森、海正、华东...https://www.cn-healthcare.com/articlewm/20210424/content-1213567.html
[4]2022年中国精神分裂药物市场规模预测:阿立哌唑为最理想药物https://www.163.com/dy/article/HCNSJGN9051481OF.html
[5]30亿美元,住友制药再出手——本周投资大事件https://mp.weixin.qq.com/s/1FYolXxQl_ZiMxfxVyJUKA
[6]BRIEF—USPTO decides Latuda patent claims are ‘unpatentable’https://www.thepharmaletter.com/in-brief/brief-uspto-decides-latuda-patent-claims-are-unpatentable

END
(图片来源 | 网络)



















